新聞資訊
News市場監管總局2024年10月30日發布《在產在售“無有效期和無產品技術要求”保健食品集中換證審查要點》的公告,公告自發布之日起施行。
一、基本要求
1、在產在售的雙無產品,省局以現行生產許可政策執行,不得以換證作為發放生產許可的前置條件。
2、換證時間要求:2023年8月31日至2028年8月30日,需要由生產許可所在省級市場監督部門根據產品實際生產執行的配方、工藝、技術要求等給出換證意見。
3、符合備案要求的或者僅做非關鍵改變即可符合備案條件的,應注冊轉備案。
二、關于安全性
1、原配方中原料個數超過現行規定的(默認為6個以內),需要提供安全性評價的綜合論證報告。
僅需自行進行產品安全性綜合論證,不需試驗。
2、配方中使用了新原料(未在食品、新資源食品、可用于保健食品原料范圍內)的,需要提供該原料的安全性綜合評價報告或原料毒理學試驗(既:急性經口毒性試驗、三項遺傳試驗、90天經口毒性及致畸試驗。)
原料安全性評估報告(建議)或原料毒理試驗
3、原料中使用了2個以上新原料的,除提供原料相關安全性證明文件(自證)以外,還應開展產品的90天經口毒性試驗和致畸試驗。
產品90天毒性試驗和致畸試驗
4、按照現行規定,若原產品涉及原料剔除或原料替換的,均應重新開展產品的毒理學試驗及安全性綜合論證報告,不建議剔除或改變。
產品毒理試驗
5、按照現行規定,原產品用到了非傳統藝的,應提供工藝對比證明材料或產品的90天毒理學實驗及原料在該工藝條件下的安全性綜合論證報告(具體問題具體分析)。
綜合論證或產品90天毒理試驗
三、關于功能性
1、涉及到原料降低用量、原料剔除或原料替換的,均需要重新開展功能試驗,包括功能性動物實驗/功能性人體試驗。
功能實驗
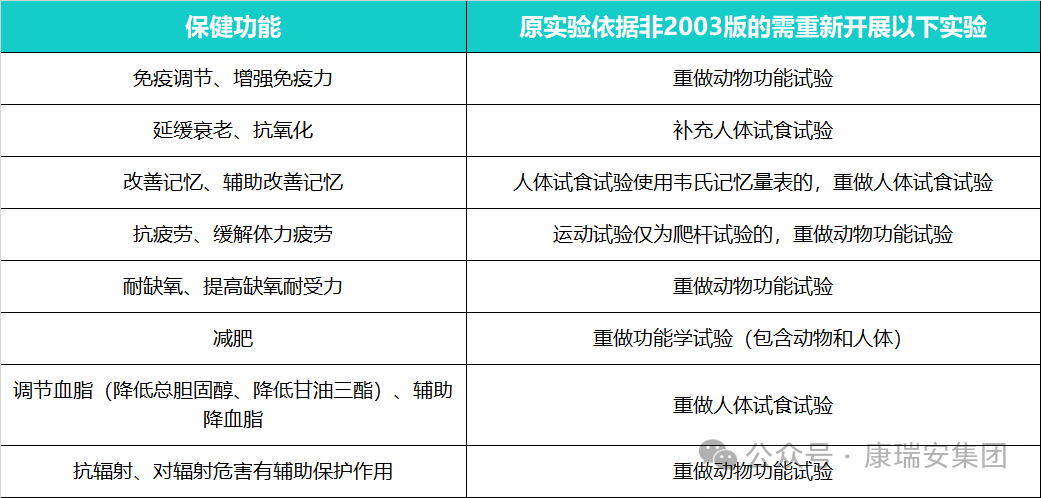
2、以下8個功能均需重新開展功能性試驗
![]()
3、原功能聲稱不在現行24個功能聲稱范圍內并無直接銜接對應的,需要在研發論證的基礎上按照現行功能學評價要求開展功能學試驗(包含功能學動物實驗/功能學人體試驗),并提出調整功能聲稱的建議和申請。
功能試驗(不建議)
四、關于技術要求修訂
修訂技術要求的,按照現行要求,需提供修訂說明并提供相應的衛、穩、功檢測報告及功效/標志性成分方法學研究報告、薄層鑒別研究報告。
五、關于換證流程
綜合評估及換證方案、配方/生產工藝/技術要求整理、省局出具換證意見、補充相關試驗、向國家局提交換證申請、國家局組織審評、審評意見修補、發放新證、6個月內組織生產。
康瑞安集團成立于2014年6月,是一家 “專業的保健食品注冊檢驗服務機構”,為保健食品、功能食品、新食品原料、化妝品、醫療器械等大健康產品,提供一站式的研究開發、檢驗檢測、毒理學評價、功能性試驗、人體臨床研究、注冊備案、咨詢認證等技術服務。
Copyright ? 2023 陜西康瑞安集團醫藥有限公司 All Rights Reserved. 陜ICP備2023009727號
 掃一掃咨詢微信客服
掃一掃咨詢微信客服